A mechanizmusok feltárása
Ezúttal inkább szakmai, mint ismeretterjesztő előadásra sikerült eljutnunk. A Semmelweis Egyetem Genetikai, Sejt- és Immunbiológiai Intézete által szervezett Semmelweis Genomikai Hálózat soron következő előadásán voltunk, melyet Dr. Wiener Zoltán tartott A vastagbéltumorok kialakulásában és progressziójában fontos mechanizmusok címmel.
A Semmelweis Genomikai Hálózat igen nagy múltra tekint vissza. A 2001-ben indult előadássorozat az elmúlt 16 évben 155 alkalommal került megrendezésre. Az előadások szervezője Prof. Falus András, az intézet korábbi (1994-2012) vezetője. 2011-ben a professzor úgy fogalmazott egyik interjújában, hogy
„Talán nem túlzás azt mondani, hogy mostanra rang lett itt megszólalni”
és ezzel egyet kell értenem. Csak hogy néhány előadót említsek, akik a biológus hallgatók számára ismerősek lehetnek, felállt már itt a pulpitusra Hudecz Ferenc, László Lajos, Nyitray László, Kacskovics Imre, Málnási-Csizmadia András, Uher Ferenc, Szathmáry Eörs, Perczel András, Erdei Anna, Vellai Tibor, Prechl József, Müller Viktor és Józsi Mihály is. Az elmúlt évek témái sokkal mélyebb háttértudást feltételeznek, mint hogy ezt az előadássorozatot ismeretterjesztőnek nevezhessük, mégis, aki érez magában affinitást a molekuláris biológia iránt, annak bátran merem ajánlani.
Dr. Wiener Zoltán
1999-ben végzett biológusként az Eötvös Loránd Tudomány Egyetem Természettudományi karán. 2005-ben szerezte meg PhD fokozatát a Semmelweis Egyetem Molekuláris Orvostudományok Doktori  Iskolában. Jelenleg egyetemi adjunktusként dolgozik a Semmelweis Egyetem Nagyvárad téri Elméleti tömbjében (NET) helyet foglaló Genetikai, Sejt- és Immunbiológiai Intézetben. Kutatási és érdeklődési területe a tumorsejtek és a stroma közötti parakrin kommunikáció vizsgálata elsősorban vastagbéltumor (CRC) modellekben, 3D organoid tenyészetek és a népszerű CRISPR-Cas9 genomszerkesztési technológia felhasználásával. Szakmai tudását jó pár külföldi tanulmányút során pallérozta, amelyek közül leginkább említésre méltó a Helsinki Egyetemen töltött 6 éves posztdoktori „tanulmányút”. Többek között a Magyar Immunológiai Társaság, az American Association for Cancer Research és az International Society for Stem Cell Research szervezetek tagja. S emellett számos kutatási díj, ösztöndíj és sikeres pályázat büszke tulajdonosa. Már másodszor adott elő eme rendezvény keretein belül.
Iskolában. Jelenleg egyetemi adjunktusként dolgozik a Semmelweis Egyetem Nagyvárad téri Elméleti tömbjében (NET) helyet foglaló Genetikai, Sejt- és Immunbiológiai Intézetben. Kutatási és érdeklődési területe a tumorsejtek és a stroma közötti parakrin kommunikáció vizsgálata elsősorban vastagbéltumor (CRC) modellekben, 3D organoid tenyészetek és a népszerű CRISPR-Cas9 genomszerkesztési technológia felhasználásával. Szakmai tudását jó pár külföldi tanulmányút során pallérozta, amelyek közül leginkább említésre méltó a Helsinki Egyetemen töltött 6 éves posztdoktori „tanulmányút”. Többek között a Magyar Immunológiai Társaság, az American Association for Cancer Research és az International Society for Stem Cell Research szervezetek tagja. S emellett számos kutatási díj, ösztöndíj és sikeres pályázat büszke tulajdonosa. Már másodszor adott elő eme rendezvény keretein belül.
A vastagbéltumorok
Vajon miért érdekesek kutatói szemszögből? Erre a kérdésre kaptunk választ az április 12-én megrendezett előadás során. Az előadó saját kutatási eredményein felül a tudomány jelenlegi állását is bemutatta a kérdésben az irodalmi adatok összefoglalásán keresztül. Jelenlegi kutatásait az újonnan felállított Molekuláris onkobiológiai kutatócsoport vezetőjeként végzi.
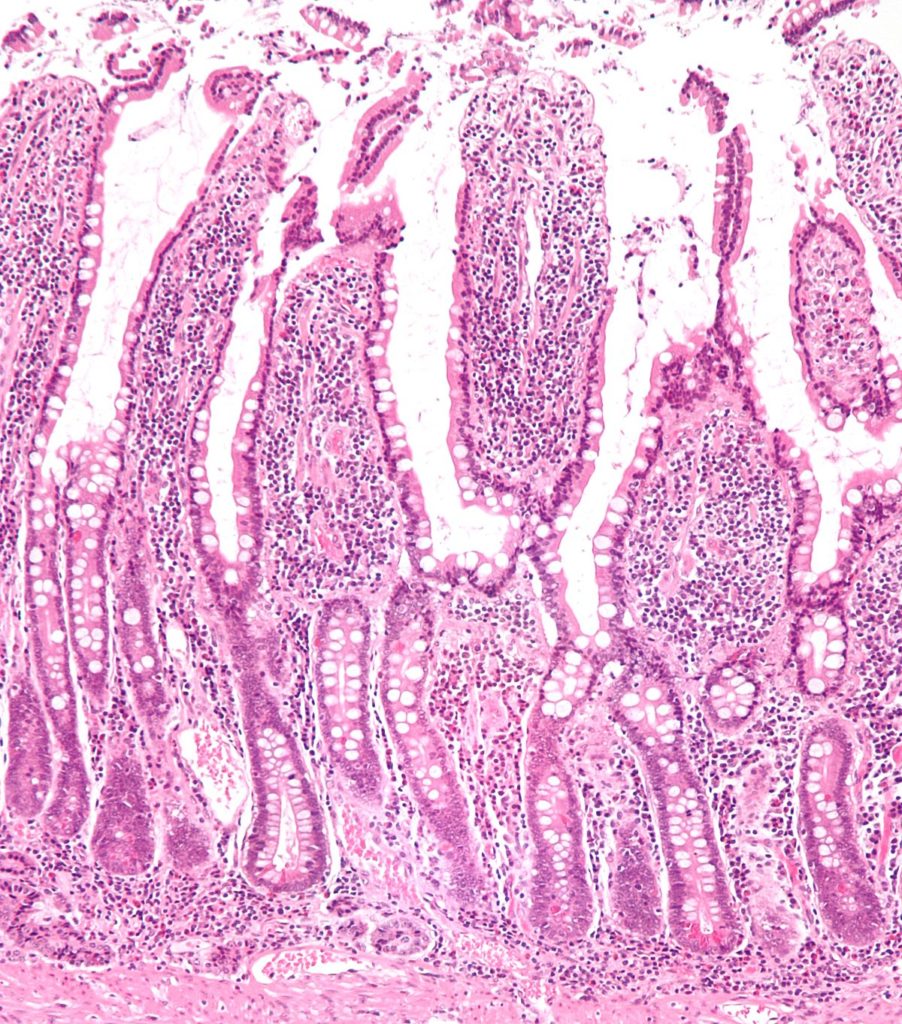
A bélrendszert anatómiailag több részre bonthatjuk. A vékonybél (intestinum tenue) részei a patkóbél (duodenum), a csípőbél (jejunum) és az éhbél (ileum), majd utána következik a vastagbél (colon) és a végbél (rectum). A bél általános felépítését nézve a vékonybélben vannak, míg a vastagbélben nincsenek bélbolyhok (villusok). Közöttük találhatók a Lieberkühn-kripták. Ebben a kriptában találhatóak enteroendokrin sejtek, kehely sejtek, Paneth-sejtek és ezek a sejtek közé beékelve a kripta alján foglalnak helyet a szöveti őssejtek. Ezek osztódnak és e folyamat során létrehoznak egy átmenetileg osztódó (transit amplifying) populációt, amelynek tagjai néhányszor osztódnak, majd kilépnek a sejtciklusból.  Nem volt triviális, hogy hol vannak az őssejtek. A klasszikus őssejt hipotézis szerint csak ritkán fordulnak elő szövetiek, de ezek a sejtek igenis gyakran fellelhetők. A vastagbéltumor 2-3. helyet foglalja el a halálozási okok listáján. Kialakulásában kulcsfontosságú szerepet játszik a Wnt útvonal. A sejtekben nagy fehérje komplexek képződnek ebben az útvonalban, melynek része az APC (adematosus poliposus coli) és CKI (caseine kinase 1), ha nincs Wnt ligand, ami a receptorhoz kapcsolódna, akkor ez az útvonal aktív és a 𝛽-katenin lebontódik, ami így nem jut be a sejtmagba és a célgénjei nem íródnak át. Ha a Wnt jel megjelenik, akkor a komplex inaktiválódik és a 𝛽-katenin bemegy a sejtmagba és a transzkripciós kofaktorok (TCF és Lef) átíródnak. Ezek segítségével a célgének is átesnek a transzkripción, ezek pedig például a Myc (protoonkogén) és az Lgr5 (őssejtmarker) gének. A vastagbéltumoros betegek 80%-ában az APC gén inaktivációja és a 𝛽-katenin állandó aktivációja figyelhető meg. Tehát akkor is működik az útvonal, ha nincs Wnt jel.
Nem volt triviális, hogy hol vannak az őssejtek. A klasszikus őssejt hipotézis szerint csak ritkán fordulnak elő szövetiek, de ezek a sejtek igenis gyakran fellelhetők. A vastagbéltumor 2-3. helyet foglalja el a halálozási okok listáján. Kialakulásában kulcsfontosságú szerepet játszik a Wnt útvonal. A sejtekben nagy fehérje komplexek képződnek ebben az útvonalban, melynek része az APC (adematosus poliposus coli) és CKI (caseine kinase 1), ha nincs Wnt ligand, ami a receptorhoz kapcsolódna, akkor ez az útvonal aktív és a 𝛽-katenin lebontódik, ami így nem jut be a sejtmagba és a célgénjei nem íródnak át. Ha a Wnt jel megjelenik, akkor a komplex inaktiválódik és a 𝛽-katenin bemegy a sejtmagba és a transzkripciós kofaktorok (TCF és Lef) átíródnak. Ezek segítségével a célgének is átesnek a transzkripción, ezek pedig például a Myc (protoonkogén) és az Lgr5 (őssejtmarker) gének. A vastagbéltumoros betegek 80%-ában az APC gén inaktivációja és a 𝛽-katenin állandó aktivációja figyelhető meg. Tehát akkor is működik az útvonal, ha nincs Wnt jel. 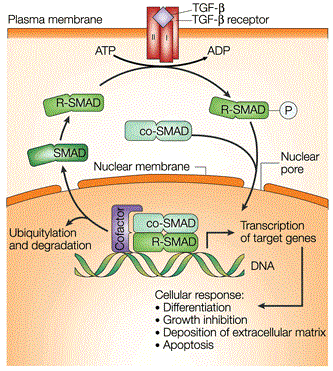 Az őssejtek más sejtekkel vannak körbefogva, ezek a vékonybélben a Paneth-sejtek, a vastagbélben Paneth-szerű sejtek, melyek funkciója kicsit eltér. A vékonybélben lévő őssejt niche nem csak antimikrobiális hatással bír, hanem elősegítik az őssejtek túlélését és növekedését növekedési faktorok termelésével. Ilyen faktorok például EGF, Notch, Wnt ligandok. Van egy plusz 4-es sejteknek nevezett populáció, amely jel visszatartó sejtekből áll, de nem ezek az őssejtek, mivel nem jellemző rájuk az aszimmetrikus osztódás. Osztódás után két ekvivalens sejt keletkezik, hogy mi lesz belőle (őssejt vagy transit amplifying sejt) az azon múlik, hogy milyen faktorok vannak a környezetében). Aki megkapja az őssejt jelet, az őssejt lesz, aki nem, annak nincs más választása el kell indulnia a differenciáció felé. Az Lgr5 egy ilyen tipikus őssejt marker. Arra, hogy honnan indul ki a tumorigenezis két hipotézis is létezik, az egyik a Top-down, a másik a Bottom-up. A Top-down hipotézis szerint korai léziók keletkeznek a kripták oldalán, míg a Bottom-up a kripták alján kezdődik a tumorigenezis és tejed felfelé. Az APC mutáció az őssejtekben Bottom-up elképzelést támasztja alá, ha az átmenetileg osztódó sejtekben (TA) történik ilyen DNS károsodás, akkor maximum rövid távú tumorigenezis történik, de az is lehet, hogy semmi nem történik, ám ha az őssejtekben következik be, akkor igen gyors rákképződés figyelhető meg. Természetesen ez egy összetett betegség, így többféle csoportba osztható vastagbéltumor.
Az őssejtek más sejtekkel vannak körbefogva, ezek a vékonybélben a Paneth-sejtek, a vastagbélben Paneth-szerű sejtek, melyek funkciója kicsit eltér. A vékonybélben lévő őssejt niche nem csak antimikrobiális hatással bír, hanem elősegítik az őssejtek túlélését és növekedését növekedési faktorok termelésével. Ilyen faktorok például EGF, Notch, Wnt ligandok. Van egy plusz 4-es sejteknek nevezett populáció, amely jel visszatartó sejtekből áll, de nem ezek az őssejtek, mivel nem jellemző rájuk az aszimmetrikus osztódás. Osztódás után két ekvivalens sejt keletkezik, hogy mi lesz belőle (őssejt vagy transit amplifying sejt) az azon múlik, hogy milyen faktorok vannak a környezetében). Aki megkapja az őssejt jelet, az őssejt lesz, aki nem, annak nincs más választása el kell indulnia a differenciáció felé. Az Lgr5 egy ilyen tipikus őssejt marker. Arra, hogy honnan indul ki a tumorigenezis két hipotézis is létezik, az egyik a Top-down, a másik a Bottom-up. A Top-down hipotézis szerint korai léziók keletkeznek a kripták oldalán, míg a Bottom-up a kripták alján kezdődik a tumorigenezis és tejed felfelé. Az APC mutáció az őssejtekben Bottom-up elképzelést támasztja alá, ha az átmenetileg osztódó sejtekben (TA) történik ilyen DNS károsodás, akkor maximum rövid távú tumorigenezis történik, de az is lehet, hogy semmi nem történik, ám ha az őssejtekben következik be, akkor igen gyors rákképződés figyelhető meg. Természetesen ez egy összetett betegség, így többféle csoportba osztható vastagbéltumor.
A klasszikus, Vogelstein-modell szerint bizonyos mutációk követik egymást a tumor kialakulásában: APC inaktiváció, KRAS aktiváció, TGFβ útvonal aktiválódása, p53 inaktiválódása. Ezt az útvonalat szokás kromoszóma instabilitás (chromosoma instability, CIN) vagy mikroszatellita stabil útvonalnak is hívni. Az alternatív útvonal vagy másnéven mikroszatellita instabil útvonal során a DNS hibajavító gének hibája következik be. Míg a colitis (vastagbélgyulladás) által indukált útvonal a harmadik, ekkor érdekes módon p53 korai inaktivációja figyelhető meg. Utóbbi útvonal pont a top-down elképzelésre bizonyíték. A gyulladásos citokinek az NF-κB útvonalat aktiválják, amely együtt működik a Wnt útvonallal. Ha a gyulladásos citokinek is jelen vannak az APC mutáció mellett, akkor Top-down mechanizmus szerint korai léziók keletkeznek. Érdekes módon a kutatások azt is kimutatták, hogy a magas zsírtartalmú táplálék a már differenciált sejtekben dedifferenciációs lépésekhez vezet, és a sejtek őssejtekként funkcionálva tumorigenezist indukálnak.
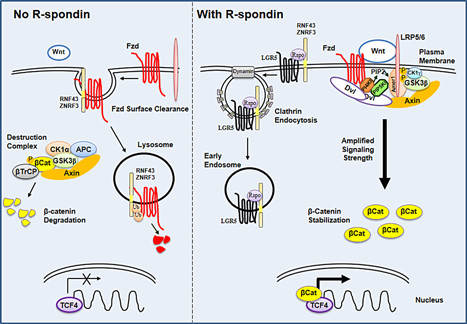
A Cancer Genome Atlas Network 2012-es publikációja nem hozott váratlan eredményeket, ugyanis ahol a DNS hibajavító enzimek nem működnek, ott több tumor keletkezik. Ám érdekes, hogy az R-spondin nevű fehérje amplifikálódása (felsokszorozódása) esetén az őssejtek proliferációja figyelhető meg.
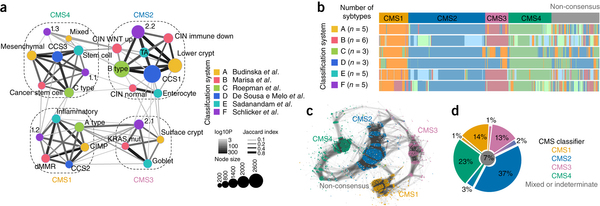
A vastagbél tumorok génexpressziója alapján is próbálták csoportba osztani a vastagbélrákos megbetegedéseket, hátha ez a betegek jobb gyógyulási esélyeihez vezet. Hat munkacsoport hat különféle eredményt kapott. Így összefogtak és egy egységes rendszer kidolgozását tűzték ki célul. A közös vizsgálat eredményeképp négy csoportot tudtak elkülöníteni, amelyeket CMS1-4-ig nevezték el. CMS1-re a limfociták beszűrődése, a DNS hibajavító enzimek nem működése és a Braf gén mutációja jellemző; CMS2 csoportban a Wnt útvonal targetjei érintettek és a klasszikus Vogelstein útvonalat követik. CMS3-nél metabolikus változások állnak be és a KRAS mutációnak magasabb a valószínűsége. CMS4-nél pedig EMT (epithelialis-mesenchimalis átalakulás) gyakori, ami az áttétképzés egyik alapmechanizmusa, így ez a legrosszabb prognózisú csoport.
Ha ez ilyen nagy probléma felmerül a kérdés, hogy hogyan lehet modellezni a tumorigenezist? Természetesen egérmodellekel. Heterozigóta formában APC mutáció egérmodellekben elérhető, és keresztezéssel véletlenszerűen heterozigótaság elvesztése megtörténhet. Ez a véletlenszerűsége miatt igen kiszámíthatalan, így indukált tumormodelleket is kialakította CRE-loxP rendszer segítségével. A CRE rekombináz elé egy szövetspecifikus promótert (Villin a teljes bélrendszer területén expresszálódik) vittek be az egyik egérbe. A CREER olyan specifikus CRE rekombináz, amelynek átíródása indukálható tamoxifennel. Két egér összekeresztezésekor nem történik semmi, csak a tamoxifen injekció esetén vágódik ki a kívánt szakasz a DNS-ből, majd ha kiürül a bevitt mennyiség a deléció rögzül az adott sejtekben. Ezek nem teljesen jól modellezik a vastagbéltumorokat. Két ok miatt, az egyik az, hogy az egerekben főként a vékonybélben alakul ki, a másik ok, hogy nem alakul ki áttét, pedig az emberben ez nagyon gyakori, de az egerekben nagyon sok polip nő, és nem jutnak el a metasztázisig, mivel hamarabb elpusztulnak a teljes bélrendszerük felborulása miatt. Ezért szükség volt egy másik módszer kitalálása, így találták ki az organoid technikát. Lgr5 pozitív őssejtek vagy Lieberkühn-kripták izolálása és 3D tenyésztése volt megoldás a problémára, amellyel a sejtek sokáig fenntarthatóak. Ezek a tenyészetek minden sejttípust tartalmaznak, amelyek a normál bélben is jelen vannak, így vizsgálhatók saját környezetükben. Vastagbéltumorokból organoid biobankok is készülnek többek között Hollandiában. Mindezen eredmények mellett máj, gyomor (normál és rákos minták), hasnyálmirigy és prosztata (normál és rákos minták) sejteket is organoid tenyésztésbe vontak, amely elkészítőiknek egy-egy magas színvonalú újságban történő publikációt jelentett. Ezzel a technikával a rákos szövetek heterogenitása is figyelembe vehető és vizsgálható. Felhasználási terület többek között az egyes mutációk hatásának vizsgálata. Példaként említette az előadó, hogy nyolc mutáns allél együttes vizsgálata egerekben az állatok ezreinek keresztezését jelenti. Itt a CRISPR-Cas9 rendszer segítségével sok allél mutációja bevihető akár egy tenyészetbe és együttesen vizsgálható. Azt figyelték meg, hogy minél több az együttes mutáció, annál kevesebb igény jelentkezik a sejtek részéről a környezeti faktorok meglétére. p53 fehérje kritikusan hozzájárul ahhoz, hogy a Vogelstein modellben lévő kromoszóma instabilitás fellépjen. Wiener Zoltán munkacsoportja is ezzel foglalkozik. Az a nagyszerű az organoid technikában, hogy úgy tűnik az egérkísérletek alapján transzplantációra
is alkalmas.
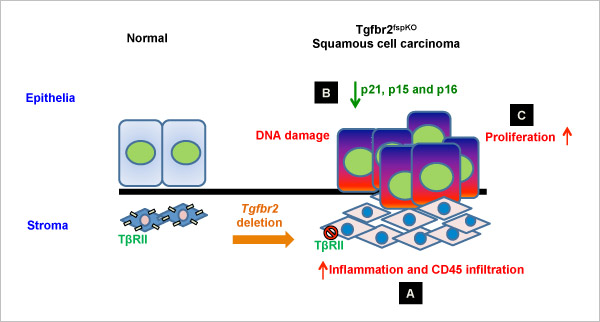
Térjünk vissza a TGFβ-ra. Ez a fehérje kezdetben a tumorsejtek túlélését gátolja, majd később tumorigenezist serkenti. A sztromában (a rákos sejtet körülvevő nem rákos sejtek, amelyek a megfelelő mikrokörnyezetet biztosítják) magas TGFβ expresszió figyelhető meg. Hatásának korai stádiumban való tanulmányozása csupán 3D organoid technika alkalmazásával van lehetőség. Hatására elindul a dezintegráció, Bim (apoptózissal kapcsolatos) molekula aktiválása, amely végső soron sejthalálhoz vezet a bélhámsejtekben és korai adenomasejtekben. Vizsgálható az is, hogy a mutációk hogyan befolyásolják egymást. Nagy a TGFβ rezisztencia a normális bélhámsejtekben, az APC mutációja esetén nagyon érzékenyek lesznek a sejtek rá, míg további KRAS mutáció esetén parciális rezisztencia alakul ki. BH3-only fehérjék közé tartozó Bim hatása is így mimikálható. Késő stádiumban a Bim aktiválódása hasonló hatást mutat, mint amilyen TGFβ hatása a korai stádiumban.
További mechanizmusok tárgyalására is sor került az előadás során, de a terjedelmi korlátok miatt ezen útvonalak ismertetésére nincs lehetőségem.
Jelenleg a Molekuláris onkobiológiai kutatócsoport az extracelluláris vezikulák szerepét vizsgálja a tumorniche kialakításában, továbbá a normál bélsejteknél mindezt a 3D organoid technika és a CRISPR-Cas9 rendszer alkalmazásával.
Minden biológia iránt érdeklődőt csak bátorítani tudok, hogy látogassatok el a következő előadásokra is. A programok az alábbi oldalon érhetőek el, ahol a hírlevélre is fel lehet iratkozni.