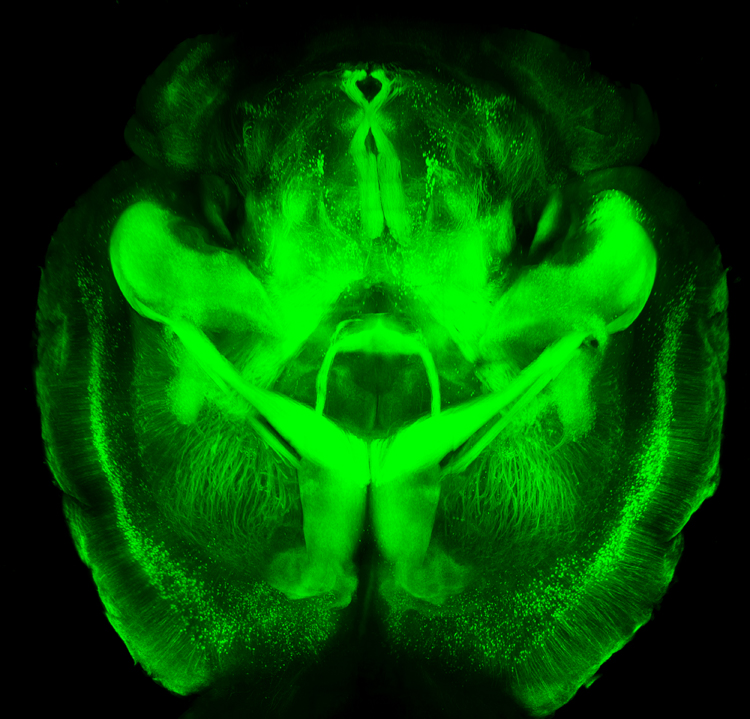
A szövetek bámulatos transzparenciája
Ha nekem pár évvel ezelőtt azt mondta volna valaki, hogy az agyba bele lehet látni, akkor azt válaszoltam volna, hogy ez valamiféle trükk vagy az illető magát az X-men univerzumba képzeli. Persze mint sok helyen itt is a megfogalmazás a lényeg: van egy technika, aminek a segítségével az agyat áttetszővé lehet tenni.
Úgy gondolom, hogy a tudomány egyik legizgalmasabb és legdinamikusabban fejlődő területe maga a módszertan. Ebbe tartoznak azok az eljárások, amelyekkel számos új ismeretre tesz szert a kutatói társadalom, s rajtuk keresztül közvetve bármelyik érdeklődő, laikus ember is. Nem beszélve arról, hogy ha a tudományos felfedezések nem rövid történelmi repertoárjára gondolunk, azt láthatjuk, hogy olykor a véletlennek köszönhető egy forradalmi tan leírása vagy épp a már meglévő technikák kombinációja, ami kívülről nézve illogikus is lehet. S ez ad egy jóval nagyobb teret az egésznek – nem feltétlenül egy jól definiált logikát követ. A most tárgyalásra kerülő eljárás esetében a vezérelv az volt, hogy hogyan lehetne elérni azt az állapotot, hogy egy adott sejtpopulációt in situ lehessen látni az agy szövetében. Nem árulok el nagy titkot, ha azt mondom, hogy ez az elképzelés megvalósult, sőt, az alapgondolatot már egyre több helyen alkalmazták és fejlesztették tovább.
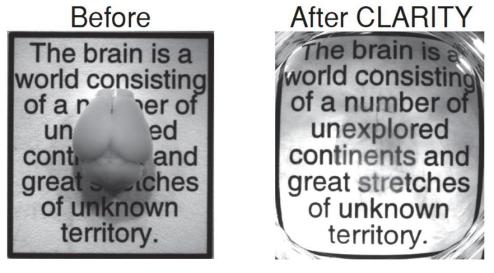 A CLARITY segít tisztábban látni az eddigi módszerekhez képest
A CLARITY segít tisztábban látni az eddigi módszerekhez képest
A felfedezés és koncepció
Az első szakirodalmi adatok a módszerről és annak hasznáról 2013-ban láttak napvilágot a Nature nevű folyóirat hasábjain. Többek között Dr. Kwanhung Chung és Dr. Karl Deisseroth volt a két szellemi szerző, akik kidolgozták a metódus koncepcióját a kaliforniai Stanford Egyetem Biomérnöki karán. Annak érdekében, hogy nagy mennyiségű információt szerezzünk meg egy összetett rendszerről, miközben egy globális perspektívát kell fenntartanunk szükséges a rendszer működésének ismerete, ami egy kulcsfontosságú fogalom a biológiában. Chung és munkatársai arra törekedtek, hogy erre a kihívásra a CLARITY nevű eljárással válaszoljanak. A részletes szerkezeti és molekuláris információ kinyerése egy intakt biológiai rendszerből az alapoktól kezdve nagyon nagy kihívásnak tekinthető. A cél hatékony elérésének érdekében több terület technológiai innovációit kell alkalmazni. Az agy szerkezetének és működésének tanulmányozása, illetve a kettő egymásra hatásának vizsgálata a mozgatórugója az idegtudományi kutatásoknak. Egy intakt szerv vagy szövet tanulmányozása eddig elég felszínesen történt, ugyanis amint beleavatkozunk művi/preparációs úton az adott struktúrába, a manipuláció következtében némi változást idézünk elő. Ezért is korszakalkotó megoldás az intakt szervvel vagy szövettel kísérletek számossága, s végső soron a transzparens szövet technológiai kialakítása. Röviden és szakmaian megfogalmazva ez egy olyan eljárás, ahol az intakt szövetet átalakítják egy nanopórusos hidrogél-hibridizált formává, amit három dimenzióban keresztkötnek hidrofil polimerekkel, amik teljes mértékben összetartják a rendszert, s mindamellett optikailag transzparens (átlátszó) és a makromolekuláknak permeábilis a közeg, azaz áteresztő. Először egér agyakon demonstrálták a módszert. Ily módon egy újfajta intakt képet kaptak a hosszú neuron projekciókról, a helyi neuronális körök huzalozásáról, a sejt-sejt kapcsolatokról, sőt még a sejt szintje alatti (szubcelluláris) szerkezetekről, fehérje komplexekről, aminosavakról és ingerületátvivő anyagokról (neurotranszmitterekről). Ez az eljárás olyan szinten is bevált és működik, hogy a továbbra is intakt szöveten lehetséges további eljárásokat is alkalmazni, mint például a cDNS vagy RNS jelölésen alapuló in situ hibridizáció (ISH), az immunhisztokémiai festések vagy a specifikus antitest jelölések a szövet mélyén. S ezt tovább tetézve lehetségessé vált, a paraméterek megváltoztatásával a klinikai alkalmazás is, ahol humán agyszöveti mintákon végeznek szerkezeti elemzéseket. Ezeket a nem-metszett szöveteket természetesen patológiás körülmények között vizsgálják neurológiai és pszichiátriai mintákon. A tanulmány még tovább ment, mint azt a szem engedheti, ugyanis az eljárás megengedte, hogy a molekuláris szintű felbontás és képalkotás is működhessen ezzel a metódussal. Ez eddig egy elérhetetlen célnak minősült a biológiában. Az alkotók már a kezdetektől fogva törekedtek arra, hogy a gyors szövettranszformációval a körülményekhez képest megőrizzék annak natív formáját sejtszinten is. Tudomásul vették azt a tényt, hogy a sejteket körülvevő lipid kettős réteg (plazmamembrán vagy Unit Membrane), ami kémiailag is kettős természetű a szerkezéből adódóan optikailag a sejteket, szöveteket nehezen hozzáférhetővé teszik. Az alapfeltételezés az volt, hogy mi történne akkor, ha ezt el lehetne távolítani roncsolásmentesen. Ilyen esetben a fény és a makromolekulák könnyedén be tudnánk jutni (penetrálni) az intracelluláris térbe. Azáltal, hogy ezt a diffúziós, fizikai gátat eltűntették, lehetővé vált egy háromdimenziós képalkotás és egy immunhisztokémiai elemzés a sejtek szétválasztása nélkül. Azonban a sejtek számára szerkezeti integritást biztosító membrán eltávolításával a sejtekben lévő biomolekulák megőrzése bizonytalanná válik, ami a molekuláris és sejtes információk elvesztéséhez, makroszkopikus szinten pedig egy mély szöveti károsodáshoz vezet. Ennek a megelőzése érdekében először egy fizikai váz szükséges a szövet elemeinek megtartásához, illetve a biológiai információ megőrzéséhez. Erre a kihívásra válasz a CLARITY. Ez a szó egy betűszó (akroníma), ami az eredeti, angol nyelvű változatból leginkább így fordítható le: tiszta, lipid-cserélt akrilamid-hibridizált, merev képalkotó/immunfesthető/in situ hibridizálható szöveti-hidrogél (Clear Lipid-exchanged Acrylamide-hybridized Rigid Imaging/Immunostaining/In situ hybridization-compatible Tissue-hYdrogel). Bár a megnevezés nem fedi le teljes mértékben a valóságot, ugyanis a megfogalmazásban szűken szerepelnek azok a befecskendezhető elemek, amelyek igazából változtathatók. Nem feltétlenül kell hidrogél-monomer vagy nem szükséges, hogy a rendszer akrilamid-alapú legyen. Továbbá a befecskendezett komponensek tulajdonságai különböző mértékűek lehetnek a tisztaságra (átláthatóságra), a merevségre és a makromolekula-permeabilitásra vonatkozóan.
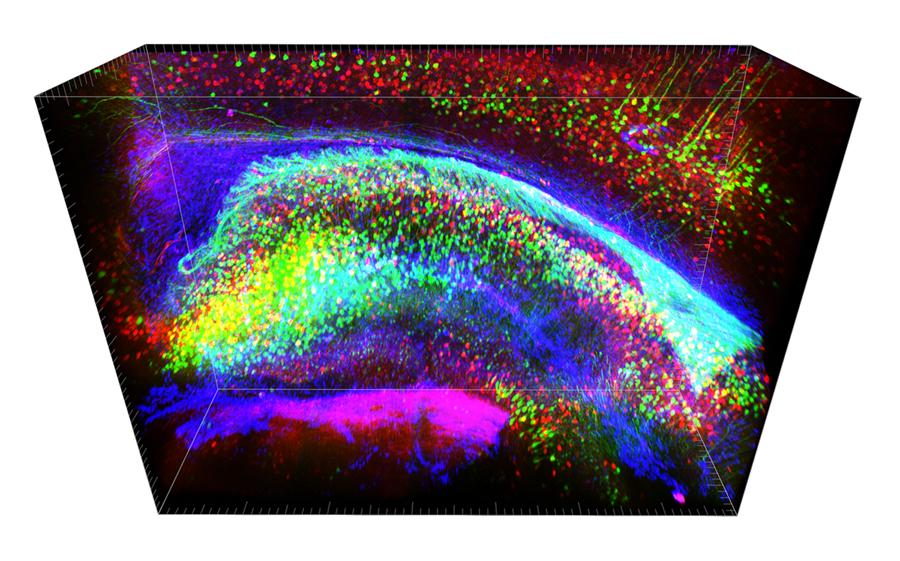
Brainbow + CLARITY egér hippocampusának tömbszelvénye in silico analizálásra készen
A protokoll
Mára már számos, különféle protokoll létezik a módszer széleskörű alkalmazásából adódóan. Mindegyikben közös az, hogy ugyanabból az alapból indult el. Mindenekelőtt egy hidrogél oldatot kell készíteni. Mellékesen jegyzem meg, hogy ezzel a fogalommal az agráriumban is találkozhatunk, ugyanis a kereskedelmi forgalomban kapható akrilamid polimert a termőföld kiszáradásának megakadályozására és a növények gyökerei felé történő nedvességközvetítőként használják előszeretettel. A teljesség igénye nélkül a receptet csak felületesen, az anyagok ismertetésével ábrázolnám. Az oldat elkészítéséhez különböző arányú akrilamid és bisz-akrilamid monomereket kell felhasználni, amiket egy foszfát-puffert (PBS) és egy paraformaldehidet (PFA) tartalmazó oldatba kell keverni. Végső lépésként hozzá kell adni a rendszerhez egy úgynevezett iniciátor (katalizátor) anyagot, amelynek az összetétele természetesen a felhasználók számára nem ismert. Emellett az oldat biztonsági szabályozása is megér egy misét, ugyanis a felhasznált anyagok közül a PFA irritációt és érzékenységet vált ki, de emellett egy rákkeltől (karcinogén) méreg is. Az akrilamid egy erős idegméreg (neurotoxin), ami szintén karcinogén és légzőszervi megbetegedést, valamint bőrirritációt okoz. A folyamat során tehát nagymértékben kell ügyelni a biztonságra zárt öltözet és maszk, illetve védőszemüveg formájában. Kis elrettentés végett 2002-ben egy Svéd kutatás eredményeként publikálták, hogy akrilamid keletkezik minden szénhidráttartamú ételben, amit sokáig magas, 150°C feletti hőmérsékleten készítenek és/vagy kezelnek. Bár ez esetben a karcinogenitás ténye vitatott mind a mai napig a Cancer Research UK munkatársai szerint. Ha készen van az oldat, utána lehetőleg nagyon alacsony, 0°C alatti hőmérsékleten kell tartani az oldatot, nehogy elinduljon a polimerizáció. Egyes eljárások alkalmával egy szaponin nevű felületaktív glikozidot kevernek az oldathoz, hogy megkönnyítsék a diffúzióját a hidrogél monomernek és az iniciátornak a szövetbe. Ezt olyan esetekben alkalmazzák, amikor egyszerűen nincs lehetőség egy nagyobb szervnél (nem csak az agynál) például szívbe juttatott (intracardialis) perfúzióra. Ilyen eset a post-mortem humán agyszövet vagy a zebrahal (Danio rerio) egész agya. Emellett a szaponin megrövidíti a hidrogél monomer inkubációs idejét az eljárás során. Hátulütője ennek a vízoldékony segédvegyületnek, hogy a nem rutinos emberek kezébe azért nem ajánlatos a használata, mert buborékok keletkeznek. Alapvetően olyan tulajdonágai vannak a vegyületnek vizes közegben, mint a szappannak. A neve önmagában is beszédes, de ez alapvetően az élővilágról mintázott dolog, ugyanis a Szappanfafélék családjának (Familia Sapindaceae) tagjaiban fellelhető ez a vegyület. Magát a perfúziós folyamatot is alacsony hőmérsékleten kell elvégezni, vagy ahogyan az eredeti szöveg írja, jégen , mert az a biztos. Az alacsony hőmérséklet azt a célt is szolgálja, hogy a vizes fázisú rendszerek térfogata megnő és így a szövet effektív térfogata is tágul. Ez nagyon kényes folyamat, ezért indokolt a sok, körülményes lépés. A következő állomás a hidrogél szövetbe ágyazása. Ezt egy olyan fülkében kell elvégezni, amelynek jó a szellőzése és az elszívó rendszere, ugyanis sok, az egészségre veszélyes anyag illékony és a megfelelő öltözék mellett így is ügyelni kell a biztonságra és a rizikófaktorokat a lehető legalacsonyabbra kell redukálni. Mielőtt az anyagot belepenetráltatjuk a szövetbe, egy kúpos csőbe kell elhelyezni, amihez egy műanyag csövet és egy vákuum pumpát csatlakoztatunk, hogy elzárjuk a gélt a légköri oxigéntől. Amint ez megtörtént a benne lévő levegőt ki kell cserélni 100% nitrogénre, ugyanis az oxigén megakadályozza (jelentően csökkenti) a hidrogél polimerizációt. Ha ez megtörtént, akkor megkezdődik a preparátum átmosása, amely először szobahőmérsékleten, majd egyre nagyobb hőfokon következik be. Pár nap elteltével a szövetet/szervet egy speciális, erre kialakított elektroforetikus tisztító kamrába (X-CLARITY ETC Chamber) kell helyezni, ahol folyamatos meleg víz és hidorgél oldat kering, valamint a szövetbe szövettől függően 10-60 V feszültséget vezet a gép. Pár napot kell ebben a kamrában is eltöltenie a majdnem kész objektumnak, majd a legvégén kétszer át kell mosni manuálisan PBS-sel. Ha ez megtörtént a preparátum készen áll a képalkotásra. Az előkészítés során 2 nappal a felvételek készítése előtt 80%-os glicerin oldatba kell helyezni az egész mintát. A fénymikroszkópos vizsgálathoz készített mintát nagyon körülményesen vagy már az előre elkészített és megvehető tartóba helyezve készen is áll a vizsgálatra.
A CLARITY eljárás optogenetikai módszerekkel kombinálva is tökéletesen működik.
Egyéb felhasználás
Az alapkoncepció továbbfejlesztése és átvariálása során számos más, egyéb lehetőséget tárt fel a CLARITY. Az in planta szöveti transzparencia alapjairól, s annak transzlációs szerepéről korábban a rovat vezetője, Kelemen Andrea értekezett A spenót jó (a) szívnek címmel. A technikát már olyan szintig fejlesztették, hogy 2015-ben a Scientific Reports című folyóiratban meg is jelent egy önálló cikk PEA-CLARITY címmel, amelyben háromdimenziós molekuláris szintű képalkotást tettek lehetővé a növényi szervezeten in toto. Ebben az esetben az eredeti protokollhoz képest annyival módosították az ötletet, hogy a dohányban (Tobacco sp.) és a lúdfúben (Arabidopsis thaliana) úgynevezett Plant Enzyme-Assisted (PEA) módszerrel, enzimatikusan, de ugyanúgy akrilamid-alapú rendszerrel értek el transzparenciát. Az állati és a humán mintákat kezelő kutatók pedig klinikai szinten is igyekeztek kamatoztatni a technika örökségét. Dr. Rajou Tomer és Dr. Karl Deisseroth 2014-ben publikálták le a Nature Protocols című folyóiratban a COLM (CLARITY-Optimized Light Sheet Microscopy) nevű mikroszkópos eljárást, ami alapvetően a közepes felbontású, ámde annál gyorsabb és hatékonyabb optikai szeletelő képességgel bíró Light-Sheet Fluorescent Microscopy (LSFM) technikán nyugszik. Érdekesség, hogy a szerző Deisseroth volt az egyik személy, aki felfedezte és leírta a CLARITY-t. 2016-ban pedig a müncheni Ludwig Maximilians Egyetem kutatóinak sikerült elérni azt az újabb mérföldkövet, ami során egy kisemlős egész testét sikerült leképezni egy hasonló módszerrel, amit uDISCOnak neveztek el (Ultimate 3D-imaging of solvent-cleared organs). S hogy ezt még hova lehet fokozni? Nos, a válasznak csak a fantáziánk szabhat határt. Soraim zárásaképp pedig meg szeretném osztani kedves Olvasókkal Dr. Francis Sellers Collins, amerikai orvos-genetikus és a marylandi Nemzeti Egészségügyi Intézetek (National Institutes of Health; NIH) igazgatójának 2013-as Az agy: Most látsz, nemsokára nem fogsz (The Brain: Now You See It, Soon You Won’t) című írásában megfogalmazott gondolatait, amelyet a felfedezést követően jegyzett le:
„A CLARITY hatalmas felfedezés. Ennek segítségével a kutatók képesek tanulmányozni a neurológiai betegségeket és rendellenességeket, a beteg vagy sérült részekre fókuszálva anélkül, hogy eltűnne a globális perspektíva. Ez valami olyasmi, ami sosem volt elérhető három dimenzióban azelőtt”.
Forrás:
Chung, K., et al. (2013). Structural and molecular interrogation of intact biological systems. Naturehttp://www.cancerresearchuk.org/
http://hydrogel.hu/
http://clarityresourcecenter.org/
Palmer, W. M., et al. (2015). PEA-CLARITY: 3D molecular imaging of whole plant organs. Scientific reports,Tomer, R., et al.. (2014). Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nature protocols
Pan, C.,et al. (2016). Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods.